Białaczka czy chłoniak kojarzą się tak źle, że pewnie trudno uwierzyć w to, iż może je zwalczyć nasz własny układ odpornościowy. Ale może, i to bardzo skutecznie – przy wsparciu wyjątkowego typu komórek
o nazwie CAR-T.
Coraz bardziej sceptycznie podchodzimy do wszelkich medycznych nowości, zwłaszcza tych, które zachwalane są w internetowych memach krażących wiralowo na mediach społecznościowych. Ta sieciowa wolność wypowiedzi sprawia jednak, że o wiele szybciej uwierzylibyśmy w cudowny lek zawierający wysokie dawki witaminy C, jeśli poleca nam go sąsiadka czy znana aktorka, aniżeli w to, że nasze własne komórki odpornościowe nagle zaczną walczyć z rakiem.
Okazuje się jednak, że od pewnego czasu to jest właśnie jedna z najskuteczniejszych metod leczenia nowotworów: immunoterapia.
Czwarty filar leczenia nowotworów
Standardem w leczeniu nowotworów pozostawały dotąd trzy filary: chemioterapia, radioterapia i chirurgia. Od niedawna immunoterapia, czyli zaangażowanie do walki z chorobą własnego układu odpornościowego, stała się czwartym filarem leczenia, zwłaszcza po tym, jak w ubiegły roku laureatami Nagrody Nobla z fizjologii lub medycyny zostali James P. Allison oraz Tasuku Honjo1. Obaj zostali docenieni przez Komitet Noblowski za badania, które pozwoliły na opracowanie zupełnie nowych i niezwykle skutecznych terapii przeciwnowotworowych polegających na „odblokowaniu” hamulców w komórkach układu odpornościowego tak, by same atakowały komórki nowotworowe.
Zagadnień związanych z immunoterapią nowotworów wystarczyłoby na wiele doktoratów, ograniczymy się zatem do jednej, wyjątkowo interesującej metody z całego arsenału immunoterapii: przyjrzymy się terapii z wykorzystaniem komórek CAR-T. To przełomowa, jednorazowa terapia, która wykorzystuje własne limfocyty T pacjenta do walki z jego nowotworem, u części chorych dając trwały efekt wyleczenia2.
Co to takiego i jak działa CAR-T?
Limfocyty T mają na swojej powierzchni wyjątkowy rodzaj receptorów (nazywanych po prostu TCR, czyli T cell receptor) umożliwiających im rozpoznawanie patogenów, lub chociaż ich fragmentów3. Za pomocą tych samych receptorów mogą one zidentyfikować białka na powierzchni komórek nowotworowych3. Niestety, u wielu pacjentów liczba limfocytów T jest zbyt niska lub nie działają one tak, jak powinny, aby zwalczyć powstający nowotwór3,4. Pamiętajmy, że jest bardzo wiele podtypów limfocytów T i nie wszystkie zajmują się walką z nowotworami3.
Naukowcy wpadli zatem na pomysł, aby stworzyć w laboratorium całe armie limfocytów T, zdolnych do walki z nowotworem – bo posiadających odpowiednie receptory na swojej powierzchni5. Takie reprogramowane limfocyty T mogłyby rozpoznawać i zabijać komórki nowotworowe w organizmie pacjenta, wspierając lub zastępując gorzej działające własne limfocyty6,7,8.
Zasada “produkcji” takich limfocytów jest dosyć prosta: umieszczamy w ich genomie nowy gen albo kodujący cały receptor TCR (umożliwiający rozpoznanie antygenów na powierzchni nowotworu pacjenta), albo specjalnie przygotowany modyfikowany receptor TCR, zwany CAR (chimeric antigen receptor), który ma dodatkowo inne, nadane mu przez badaczy funkcje9. Stąd też nazwa reprogramowanych w ten sposób limfocytów: CAR-T cells, czyli skrót od angielskich słów „chimeric antigen receptor T cells”9.
Ten drugi z wymienionych rodzaj receptora, CAR, nazywany jest chimerycznym, ponieważ łączy w sobie elementy przeciwciała rozpoznającego białka powierzchniowe nowotworu z elementem wzmacniającym i sygnalizacyjnym, uruchamiającym opcję “zabić!!!”, gdy tylko limfocyt rozpozna swój cel9. Dodatkowo trwają badania nad dodaniem innych elementów do komórek CAR-T, które mogłyby jeszcze bardziej wzmocnić działanie terapii. Na przykład zaopatrzenie komórek w geny odpowiedzialne za produkcję niektórych cytokin – to takie małe białka, które służą do sygnalizacji międzykomórkowej w organizmie3,10,11. Cytokiny uwalniane przez komórki CAR-T mogłyby zatem werbować inne rodzaje komórek układu odpornościowego pacjenta do pomocy w walce z nowotworem, czyniąc terapię jeszcze skuteczniejszą3,10,11. W ten sposób utworzyłaby się mikroskopijna „armia” komórek walczących po naszej stronie w słusznej sprawie.
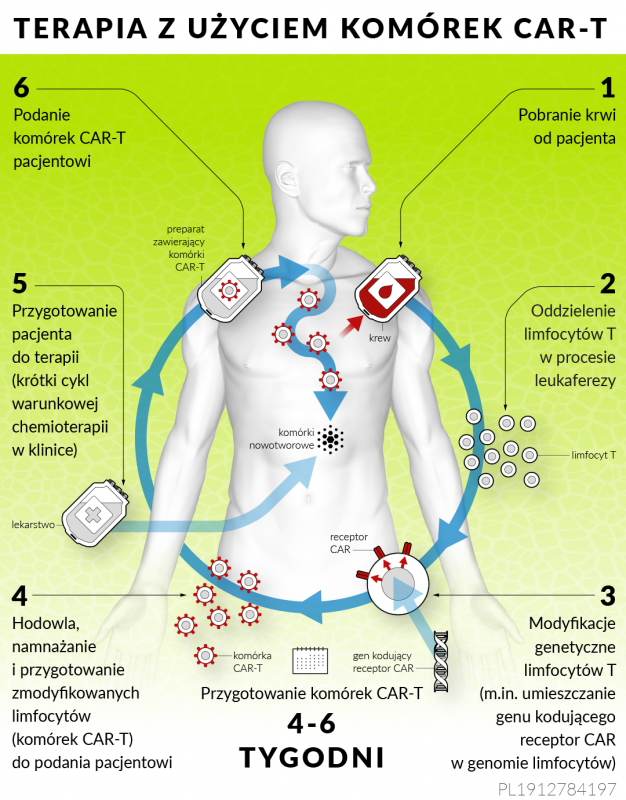
Podsumowując: CAR-T cells to zaawansowana technologia immunoterapii, tworzona z myślą o wykorzystaniu własnego układu odpornościowego pacjenta do walki z nowotworem. To jedna z tych nielicznych terapii antynowotworowych, które dają szansę na zupełne wyleczenie. Należy do podgrupy nowoczesnych immunoterapii nazywanych Adoptive Cell Therapy (ACT)9. W skrócie, jest to nowatorska metoda leczenia nowotworów, polegająca na pobraniu od pacjenta limfocytów T[1], następnie przeprowadzeniu ich modyfikacji w laboratorium, namnożeniu tak przygotowanych komórek i wstrzyknięciu ich ponownie pacjentowi12. Cały proces trwa kilka tygodni, a przygotowanym lekiem są tak naprawdę własne komórki pacjenta – z tym, że zmodyfikowane i namnożone tak, aby dały radę wygrać z nowotworem9.
Historia przełomowego odkrycia w pigułce
Ten rodzaj immunoterapii wydaje się być prawdziwym przełomem ostatnich lat, ale tak naprawdę pomysł ten narodził się już pod koniec XIX wieku. Najpierw niemieccy lekarze, Fehleisen i Busch, podjęli pierwsze znane w literaturze medycznej próby zaangażowania układu immunologicznego pacjenta. Mimo, iż wtedy nie mieli pojęcia o funkcjonowaniu układu immunologicznego, ani nie zostały jeszcze odkryte limfocyty, przeprowadzili szereg prób i zaobserwowali zmniejszanie się guzów nowotworowych po zakażeniu różą12,13. Następnie William Bradley Coley, którego dzisiaj nazywa się Ojcem Immunoterapii, dokonał pierwszych naukowo udokumentowanych (1891) prób wykorzystania zdolności układu immunologicznego pacjentów do zwalczania nowotworów: mięsaków, zazwyczaj agresywnych nowotworów kości 14,15,13.
Niedługo potem, w 1902 roku, dwóch niemieckich naukowców, Ferdinand Blumenthal i Ernst von Leyden z Berlina, podjęło pierwszą próbę „zaszczepienia” pacjenta przeciwko jego własnemu nowotworowi, używając do tego celu komórek rakowych pobranych wcześniej od tego samego pacjenta16,17.
Podobne roztwory („szczepionki”) autologicznych komórek rakowych (czyli pobranych od tego samego pacjenta, któremu zostaną podane) wykonywali dla kilku kolejnych pacjentów, chorujących na raka
w zaawansowanej postaci. Badacze zaobserwowali niewielką i dość subiektywną poprawę u części leczonych pacjentów, ale żadna spektakularna poprawa nie została wtedy odnotowana. Co istotne, również wielkość guzów u żadnego z pacjentów nie uległa zmianie17.
Metoda sztucznego tworzenia takich komórek, które mogłyby pochodzić od pacjenta i zwalczać jego własny nowotwór, opisana została po raz pierwszy w latach 60. XX wieku18. Również wtedy przeprowadzono pierwsze eksperymenty na myszach, jednak i tutaj nie było jeszcze spektakularnego sukcesu. To dlatego, że w latach 60. i 70. dopiero poznawaliśmy nasz układ immunologiczny, odkrywaliśmy z jakich składa się komórek, do czego one służą i jak działają. Zresztą, uczymy się tego do dziś, bo układ immunologiczny (obok neurologicznego) pozostaje jednym z najmniej poznanych układów ludzkiego ciała: do tego stopnia, że immunolodzy od czasu do czasu donoszą na łamach prestiżowych czasopism naukowych o odkryciu nowych typów komórek immunologicznych!
W latach 80. i 90. nastąpiła seria przełomowych doświadczeń, przeprowadzonych w laboratoriach USA i Izraela, które doprowadziły do powstania technologii CAR-T, jaką znamy dzisiaj. Pierwsze terapeutyczne wykorzystanie genetycznie zmodyfikowanych limfocytów T miało miejsce już w latach 80.19,20. Od tego czasu powstało już bardzo wiele modyfikacji tej metody, jednak najbardziej obiecującą i bez wątpienia najskuteczniejszą (jak dotąd) pozostaje technika wykorzystująca właśnie komórki CAR-T.
W 1986 roku grupa Stevena Rosenberga wykorzystała limfocyty infiltrujące guza (ang. tumour infiltrating lymphocytes, TILs), aby zmodyfikować je i namnożyć w warunkach laboratoryjnych, a następnie ponownie podać pacjentowi21. Zdecydowano się na wykorzystanie TILs, ponieważ znajdują się w otoczeniu komórek nowotworu, istnieje zatem duża szansa, że przynajmniej niektóre z nich będą posiadały odpowiednie „kwalifikacje” do walki z komórkami nowotworowymi. Przypuszczenia okazały się słuszne: wyraźna poprawa u części pacjentów wzmocniła przekonanie naukowców, że nasze własne limfocyty mają zdolność zniszczenia nowotworu – co w tamtych czasach wcale nie było jeszcze takie oczywiste jak dzisiaj21. Pierwszy receptor CAR-T powstał w laboratorium Zeliga Eshhara22.
Jakieś nowości na horyzoncie?
Podczas gdy terapia CAR-T zaczyna być stosowana w praktyce w klinikach, naukowcy nie spoczywają na laurach i rozpoczęli eksperymenty z innymi rodzajami komórek. Na przykład komórki o pięknej nazwie NK (ang. natural killer cells) zmodyfikowane w podobny sposób, poradziły sobie świetnie z nowotworem jajnika u myszy24,25.
Kolejnym pomysłem na usprawnienie całego procesu jest wykorzystanie techniki CRISPR/Cas9: to niezwykle precyzyjne narzędzie, przy pomocy którego jest możliwa lokalna edycja genomu. Wykorzystując tę metodę, do genomu limfocytów T wprowadzono gen kodujący CAR, który również stworzony został przy użyciu nowoczesnych technik bioinżynierii26,5. Ekspresja tak przygotowanego i wprowadzonego genu CAR, a tym samym powstanie receptora na powierzchni limfocytów T , umożliwiła limfocytom dłuższą eliminację komórek nowotworowych oraz niższą podatność na tzw. “wyczerpanie” (ang. lymphocyte exhaustion), czyli stan, w którym limfocyty słabną i przestają atakować nowotwór26,27.
Co możemy wyleczyć przy pomocy CAR-T?
Oczywiście, to wszystko nie jest takie proste, na jakie może wyglądać. Przede wszystkim celem limfocytów CAR-T powinny być takie białka, które są obecne na powierzchni komórek nowotworowych, ale nie są obecne na zdrowych komórkach pacjenta8. Byłoby dobrze, gdyby celem były białka zaangażowane w jakieś istotne funkcje, np. wzrost czy przeżywalność komórek nowotworowych, wtedy samo ich zablokowanie, unieczynnienie, doprowadziłoby do śmierci komórki nowotworowej.
Komu terapia z wykorzystaniem komórek CAR-T może pomóc już dzisiaj? Sukcesy są potwierdzone na razie na wybranych grupach pacjentów, w niektórych nowotworach krwi. Pierwsza zarejestrowana terapia tego typu wykorzystywała zmodyfikowany receptor CAR wykrywający białko CD19, obecne na powierzchni nowotworowych (i nie tylko) komórek krwi8. CD19 to niewielkie białko występujące na powierzchni limfocytów B, zaliczane do rodziny immunoglobulin, istotne dla prawidłowego funkcjonowania limfocytów B28, 29.
To właśnie białaczka, a konkretnie ostra białaczka limfoblastyczna B-komórkowa (ang. acute lymphoblastic leukaemia, ALL) u dzieci i młodych dorosłych była pierwszym rodzajem nowotworu, dla którego amerykańska Agencja Żywności i Leków (Food and Drug Agency, FDA) już w 2017 roku wydała zgodę na zastosowanie terapii z wykorzystaniem komórek CAR-T a następnie również na zastosowanie u dorosłych chorych w pewnym typie chłoniaków nieziarniczych12, 32, 33, 34, 35.
Zarówno część pacjentów pediatrycznych cierpiących na nawrotową lub oporną na leczenie ostrą białaczkę limfoblastyczną B-komórkową, jak i pacjentów dorosłych ze zdiagnozowanym nawrotowym lub opornym na leczenie chłoniakiem rozlanym z dużych limfocytów B uzyskała w badaniach klinicznych terapii CAR-T trwałą odpowiedź na zastosowane leczenie. Trwała odpowiedź oznacza zwykle zupełne wyleczenie – wyobraźcie sobie, że spora część pacjentów, leczonych tą metodą już podczas pierwszych prób klinicznych, żyje do dzisiaj.
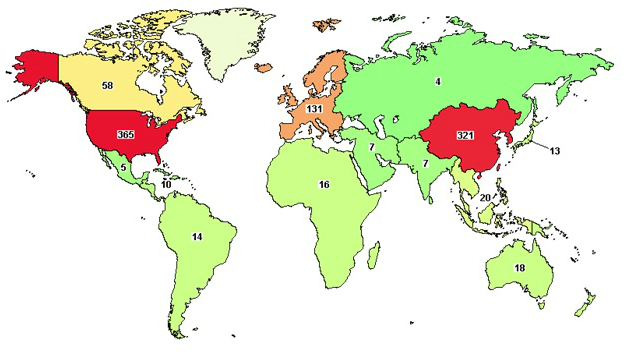
Późniejsze doświadczenia, zwłaszcza te prowadzone intensywnie w ciągu ostatniej dekady, pokazały potencjalną skuteczność terapii CAR-T również w przypadku niektórych guzów litych, a bardzo wiele prób klinicznych dla wielu innych typów nowotworów wciąż trwa. Na całym świecie w tej chwili przeprowadzanych jest 912 badań klinicznych (patrz mapka poniżej) z wykorzystaniem komórek CAR-T, a to dopiero początek30. Dla przykładu, zaledwie kilka lat temu skonstruowano receptor CAR-T wykrywający mesotelinę, czyli białko obecne na powierzchni komórek niektórych guzów litych31.
Dlaczego lekarze uznają to za przełom?40 Ponieważ opisane wyżej choroby są agresywnymi, złośliwymi nowotworami, a np. dla pacjentów z ALL lub DLBCL z nawrotem lub opornych na aktualnie dostępne metody leczenia wciąż brakuje skutecznych terapii36. W Europie ALL stanowi około 80% wszystkich przypadków zachorowań na białaczkę wśród dzieci, a słowo „ostra” (acute) w nazwie tego nowotwory krwi wskazuje na jej szybki postęp, wymagający natychmiastowego leczenia. Rokowania pacjentów, u których wystąpił nawrót choroby po zastosowaniu standardowej terapii, są bardzo niekorzystne36.
Chłoniak nieziarniczy (Non-Hodgkin lymphoma – NHL) należy do grupy nowotworów układu limfatycznego. Nowotwory te rozwijają się z limfocytów – jednego z rodzajów białych krwinek będących elementem układu odpornościowego organizmu41. U osób z NHL prawidłowe limfocyty rozrastają się w niekontrolowany sposób, gromadzą się i tworzą guzy, wypierają pozostałe rodzaje krwinek białych i osłabiają zdolność organizmu do walki z infekcją. Istnieje wiele różnych podtypów NHL41. Każdy z nich różni się ze względu na to, w jaki sposób ujawnia się u pacjentów i jakimi metodami powinien być leczony. Najczęstszym występującym rodzajem jest chłoniak rozlany z dużych limfocytów B (diffuse large B-cell lymphoma – DLBCL), który jest agresywny, złożony i trudny do leczenia42. W dodatku występuje najczęściej u osób starszych, a jego pierwsze objawy są bardzo niespecyficzne i przypominają infekcję np. powiększone są węzły chłonne, pojawia się gorączka i ogólne zmęczenie41, 42.
Dla większości pacjentów, zwłaszcza tych z nawrotem choroby, wskaźniki przeżycia od lat pozostają bardzo niskie, a metodami leczenia są zwykle chemioterapia lub autologiczny przeszczep komórek macierzystych (ang. autologous stem cell transplant, ASCT). Te metody nie dają jednak trwałych rezultatów u większości pacjentów, a zdarza się, że przeszczep, który jest skomplikowaną procedura medyczną, zwyczajnie się nie udaje37.
Wymienione powyżej nowotwory to jedynie początek długiej listy chorób, na które obecnie testuje się terapię CAR-T. I nie tylko nowotworów, bo w badaniach przedklinicznych coraz więcej jest również innych schorzeń, na przykład włóknienie serca38.
Skoro zmodyfikowane limfocyty T mogą rozpoznawać i zabijać komórki nowotworowe, to czemu nie można by ich tak zaprojektować, aby rozpoznawały i walczyły z innymi nieprawidłowymi komórkami w zupełnie innych rodzajach schorzeń? W tym wariancie terapii limfocyty T zostały tak przygotowane w laboratorium, aby rozpoznawały i zwalczały konkretny rodzaj komórek powodujących chorobę (w tym przypadku były to fibroblasty). W dodatku wybrane na cel terapii komórki musiały mieć jakąś cechę nieobecną na pozostałych, zdrowych komórkach z sąsiedztwa: taką cechą była obecność specyficznego białka FAP (ang. fibroblast activation protein)38. Badania są w toku, a pierwsze opublikowane wyniki przedstawiają się optymistycznie.
Czyżby terapia idealna dla każdego?
Oczywiście, nie wszyscy mogą skorzystać z leczenia metodą CAR-T. Dostępność tak nowoczesnej terapii różni się pomiędzy krajami EU i zależy od wielu czynników, w tym od dostosowania wykwalifikowanych ośrodków leczenia i zatrudnienia odpowiednio przeszkolonych osób. Znaczenie ma również ogólna kondycja zdrowotna pacjenta i brak przeciwwskazań do tego rodzaju terapii. To wszystko ma znaczenie dla bezpieczeństwa i zdrowia samego pacjenta –ośrodek musi posiadać odpowiedni sprzęt, a personel medyczny musi być przeszkolony, m.in. pod kątem radzenia sobie z możliwymi efektami niepożądanymi terapii.
Jak każda metoda terapeutyczna i każdy lek na świecie, tak i stosowanie komórek CAR-T niesie za sobą również ryzyko wystąpienia efektów niepożądanych. W opinii części ekspertów, w przeciwieństwie do chemioterapii czy radioterapii, które niszczą komórki chore, ale też i zdrowie, w przypadku CAR -T nie ma tych charakterystycznych skutków ubocznych23.Terapia komórkami CAR-T nie jest jednak dla organizmu obojętna. U pewnego odsetka pacjentów zaobserwowano tzw. “hyper-response” – sytuację, w której układ immunologiczny zaatakował nowotwór z ogromną siłą, a przy okazji również pacjenta, szybko doprowadzając do jego śmierci.
Dotyczy to zresztą wszystkich form immunoterapii – również przy zastosowaniu innych form immunoterapii, Zjawisko szczególnie groźne dla życia pacjenta nazywane jest w literaturze anglojęzycznej „cytokine storm”, a po polsku burzą cytokinową. Sytuacja, w której w organizmie pacjentach dochodzi nagle do uwolnienia ogromnej ilości cytokin – niewielkich białek, mających swój udział m.in. w powstawaniu stanu zapalnego w organizmie. Taka sytuacja jest groźna, a może być nawet śmiertelna, jeśli bardzo szybko nie zostanie podjęte odpowiednie działanie terapeutyczne39,12. Kluczowe jest zatem natychmiastowe rozpoznanie i podanie leków, które przywrócą równowagę w ustroju. Cały proces związany z terapią CAR-T u konkretnego pacjenta odbywać się może z zachowaniem restrykcyjnych przepisów, tylko i wyłącznie w certyfikowanym ośrodku pod opieką dedykowanego terapii, przeszkolonego personelu. Ośrodek stosujący terapię CAR-T musi być odpowiednio przeszkolony pod kątem zarządzania działaniami niepożądanymi, a także wyposażony w specjalistyczny sprzęt oraz leki, które pozwolą na ewentualną interwencję.
Tak to jednak działa w nauce, że jeśli pojawiają się problemy, naukowcy natychmiast starają się je rozwiązać, ulepszyć wynalazek, zwłaszcza wtedy, gdy stawką jest ludzkie życie. Kilka grup badawczych pracuje obecnie nad tym, jakie jeszcze modyfikacje można by wprowadzić do CAR-T, aby zminimalizować ryzyko wystąpienia opisanych powyżej efektów niepożądanych, czyli sprawić, że terapia z wykorzystaniem komórek CAR-T będzie bezpieczniejsza, przy jednoczesnym zachowaniu maksymalnej skuteczności terapii10.
Materiał powstał przy współpracy z firmą Novartis.
PL1912784197
Referencje:
1. Karolinska Instituet Nobel Prize. Press release: The Nobel Prize in Physiology or Medicine 2018. (2018). Available at: https://www.nobelprize.org/prizes/medicine/2018/press-release/.
2. Rynekzdrowia.pl, Wielką wartością terapii CAR-T cells jest to, że daje szansę na wyleczenie nowotworu, http://www.rynekzdrowia.pl/Uslugi-medyczne/Wielka-wartoscia-terapii-CAR-T-cells-jest-to-ze-daje-szanse-na-wyleczenie-nowotworu,195403,8.html
3. Sompayrac, L. How the immune system works. (Wiley Blackwell, 2016).
4. Spranger, S. Mechanisms of tumor escape in the context of the T-cell-inflamed and the non-T-cell-inflamed tumor microenvironment. Int. Immunol. 28, 383–391 (2016).
5. Wojtaszewska, M. Przyszłość dzieje się teraz: dalsze losy CAR-T. (2018). Available at: https://molekularnie.wordpress.com/2018/04/16/przyszlosc-dzieje-sie-teraz-dalsze-losy-car-t/. (Accessed: 22nd October 2019)
6. Menon, S., Shin, S. & Dy, G. Advances in cancer immunotherapy in solid tumors. Cancers (Basel). 8, 1–21 (2016).
7. Mollanoori, H., Shahraki, H., Rahmati, Y. & Teimourian, S. CRISPR/Cas9 and CAR-T cell, collaboration of two revolutionary technologies in cancer immunotherapy, an instruction for successful cancer treatment. Hum. Immunol. 79, 876–882 (2018).
8. Abel, P. CAR-T therapy works for some blood cancers, but can we make it work for brain tumours? The Conversation (2018). Available at: https://theconversation.com/car-t-therapy-works-for-some-blood-cancers-but-can-we-make-it-work-for-brain-tumours-100125. (Accessed: 25th October 2019)
9. Filley, A. C., Henriquez, M. & Dey, M. CART Immunotherapy: Development, Success, and Translation to Malignant Gliomas and Other Solid Tumors. Front. Oncol. 8, (2018).
10. Grens, K. A Revised CAR T for Lymphoma Has Fewer Side Effects. The Scientist (2019). Available at: https://www.the-scientist.com/news-opinion/a-revised-car-t-for-lymphoma-has-fewer-side-effects-65775. (Accessed: 25th October 2019)
11. Salas-Mckee, J. et al. CRISPR/Cas9-based genome editing in the era of CAR T cell immunotherapy. Hum. Vaccin. Immunother. 1–7 (2019). doi:10.1080/21645515.2019.1571893
12. Oiseth, S. J. & Aziz, M. S. Cancer immunotherapy: a brief review of the history, possibilities, and challenges ahead. J. Cancer Metastasis Treat. 3, 250 (2017).
13. Dobosz, P. Krótka i burzliwa historia immunoterapii. Immunoterapia 2, (2019).
14. Targeted Oncology. A Brief History of Immunotherapy. (2014). Available at: https://www.targetedonc.com/publications/special-reports/2014/immunotherapy-issue3/a-brief-history-of-immunotherapy. (Accessed: 8th February 2019)
15. McCarthy, E. F. The toxins of William B. Coley and the treatment of bone and soft-tissue sarcomas. Iowa Orthop. J. 26, 154–8 (2006).
16. Biotechnology?, W. is. Immunotherapy: Timeline of key events. (2019). Available at: http://www.whatisbiotechnology.org/index.php/timeline/science/immunotherapy. (Accessed: 29th April 2019)
17. Wagener, D. J. T. The history of oncology. (Bohn Stafleu van Loghum, 2009).
18. Eshhar, Z., Waks, T., Gross, G. & Schindler, D. G. Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors. Proc. Natl. Acad. Sci. 90, 720–724 (1993).
19. Gross, G., Waks, T. & Eshhar, Z. Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proc. Natl. Acad. Sci. U. S. A. 86, 10024–8 (1989).
20. Eshhar, Z. The T-Body Approach: Redirecting T Cells with Antibody Specificity. in 329–342 (2008). doi:10.1007/978-3-540-73259-4_14
21. Rosenberg, S., Spiess, P. & Lafreniere, R. A new approach to the adoptive immunotherapy of cancer with tumor-infiltrating lymphocytes. Science (80-. ). 233, 1318–1321 (1986).
22. Brower, V. The CAR T-Cell Race. The Scientist (2015). Available at: https://www.the-scientist.com/bio-business/the-car-t-cell-race-35701. (Accessed: 22nd October 2019)
23. https://www.termedia.pl/mz/Po-raz-pierwszy-w-Polsce-zastosowano-innowacyjna-terapie-CAR-T,36223.html
24. Li, Y., Hermanson, D. L., Moriarity, B. S. & Kaufman, D. S. Human iPSC-Derived Natural Killer Cells Engineered with Chimeric Antigen Receptors Enhance Anti-tumor Activity. Cell Stem Cell 23, 181-192.e5 (2018).
25. Zimmer, K. Natural Killer Cells Prove Effective as a CAR Therapy in Mice. The Scientist (2018). Available at: https://www.the-scientist.com/news-opinion/natural-killer-cells-prove-effective-as-a-car-therapy-in-mice–64456?fbclid=IwAR3CrgrIQusQ5hnWzmVqgH9Ke7CWP1dvGgLbZZ8-rlPKFHpndLV8wkumADY. (Accessed: 22nd October 2019)
26. Eyquem, J. et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature 543, 113–117 (2017).
27. Schwartz, R. H. T CELL ANERGY. Annu. Rev. Immunol. 21, 305–334 (2003).
28. Wang, K., Wei, G. & Liu, D. CD19: a biomarker for B cell development, lymphoma diagnosis and therapy. Exp. Hematol. Oncol. 1, 36 (2012).
29. Park, J. H., Geyer, M. B. & Brentjens, R. J. CD19-targeted CAR T-cell therapeutics for hematologic malignancies: interpreting clinical outcomes to date. Blood 127, 3312–3320 (2016).
30. NIH. Clinical Trials. (2019). Available at: https://clinicaltrials.gov. (Accessed: 22nd October 2019)
31. Adusumilli, P. S. et al. Regional delivery of mesothelin-targeted CAR T cell therapy generates potent and long-lasting CD4-dependent tumor immunity. Sci. Transl. Med. 6, 261ra151-261ra151 (2014).
32. NIH. CAR T-Cell Therapy Approved for Some Children and Young Adults with Leukemia. (2017). Available at: https://www.cancer.gov/news-events/cancer-currents-blog/2017/tisagenlecleucel-fda-childhood-leukemia. (Accessed: 29th April 2019)
33. NIH. FDA Approves Second CAR T-Cell Therapy for Lymphoma. (2018). Available at: https://www.cancer.gov/news-events/cancer-currents-blog/2018/tisagenlecleucel-fda-lymphoma. (Accessed: 29th April 2019)
34. NIH. With FDA Approval for Advanced Lymphoma, Second CAR T-Cell Therapy Moves to the Clinic. (2018). Available at: https://www.cancer.gov/news-events/cancer-currents-blog/2017/yescarta-fda-lymphoma. (Accessed: 29th April 2019)
35. FDA. FDA approval brings first gene therapy to the United States. (2017). Available at: https://www.fda.gov/news-events/press-announcements/fda-approval-brings-first-gene-therapy-united-states.
36. Ronson, A., Tvito, A. & Rowe, J. M. Treatment of Relapsed/Refractory Acute Lymphoblastic Leukemia in Adults. Curr. Oncol. Rep. 18, 39 (2016).
37. Crump, M. et al. Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood 130, 1800–1808 (2017).
38. Yasinski, E. CAR T Immunotherapy May Find New Use in Treating Cardiac Fibrosis. The Scientist (2019). Available at: https://www.the-scientist.com/news-opinion/car-t-immunotherapy-may-find-new-use-in-treating-cardiac-fibrosis-66416. (Accessed: 25th October 2019)
39. Decker, W. K. et al. Cancer Immunotherapy: Historical Perspective of a Clinical Revolution and Emerging Preclinical Animal Models. Front. Immunol. 8, (2017).
41. Leukeima & Lymphoma Society. NHL. http://www.lls.org/lymphoma/non-hodgkin-lymphoma?src1=20045&src2=. Accessed June 2018.
42. Lymphoma Research Foundation. Diffuse Large B-Cell Lymphoma (DLBCL). http://www.lymphoma.org/site/pp.asp?c=bkLTKaOQLmK8E&b=6300153. Accessed June 2018.
[1] Pobiera się pełną krew, a białe krwinki oddzielamy w procesie leukaferazy, czyli selektywnego odfiltrowania leukocytów.

You must be logged in to post a comment.