Coraz więcej bakterii uodparnia się na antybiotyki, którymi dysponuje medycyna. W efekcie za kilkadziesiąt lat ludzkość być może znów będzie masowo umierać na te same infekcje bakteryjne co przed erą antybiotyków.
Nie odczuwamy tego na razie, ale powoli tracimy pewniaki, na których opiera się leczenie w naszych czasach. Problemem jest nie tylko ruch antyszczepionkowy, który może zniszczyć odporność zbiorową i pozwolić na powrót groźnych epidemii. Drugim nieszczęściem, z którym przyjdzie nam się niedługo zmierzyć, jest to, że cała gama antybiotyków z biegiem czasu przestaje sobie radzić z coraz “sprytniejszymi” drobnoustrojami. Prognozy mówią, że w 2050 roku obecne na rynku antybiotyki nie będą nas już skutecznie chronić przed śmiertelnymi chorobami, co zaowocuje 10 milionami zgonów rocznie (do tej przerażającej liczby jeszcze wrócę).
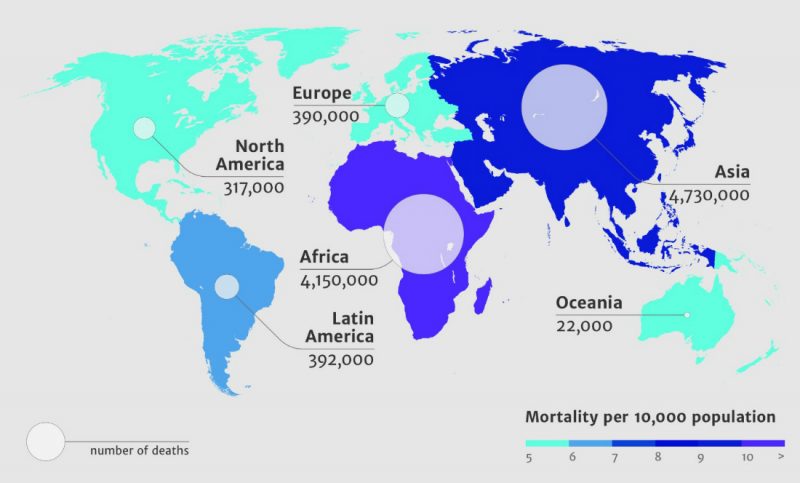
Przewidywana liczba zgonów w 2050 roku spowodowanych opornością bakterii na antybiotyki. Źródło: Review on Antimicrobial Resistance
A nowych antybiotyków powstaje żałośnie mało. Dlaczego? Niżej to wyjaśnię.
Umrzeć na skaleczenie
Przed wynalezieniem antybiotyków można było umrzeć nie tylko z powodu zapalenia płuc, ale nawet wskutek zakażenia spowodowanego drobnym skaleczeniem, które mogło zakończyć się gangreną. Ogromnym zagrożeniem była każda angina wywoływana przez bardzo powszechne i przenoszące się drogą kropelkową paciorkowce. Powikłania po nieleczonej anginie prowadzą m.in. do uszkodzeń serca wskutek zapalenia mięśnia sercowego czy też infekcyjnego zapalenia wsierdzia, a także do uszkodzenia stawów wskutek ich zapalenia. Powikłania te zniszczyły nieodwracalnie zdrowie mojej mamy, która na anginę chorowała kilkakrotnie tuż po wojnie, kiedy antybiotyki nie były powszechnie dostępne.
Kiedy w latach 60. XX wieku antybiotyki masowo wchodziły na rynek, eliminowały praktycznie 100 proc. zakażeń. Dziś stały się ofiarą własnej popularności – stosuje się je zarówno w sytuacjach, które tego wymagają, jak i w tych, które wykluczają ich użycie. Przykład? Nie tak dawno nasz przyjaciel narzekał na infekcję, która ewidentnie wyglądała na wirusową (gwałtowny atak kataru, kaszel, gorączka i ogólne rozbicie). A już kilka dni później wyznał, że poszedł do lekarza i ten przepisał mu antybiotyk, tylko że nawet po kilku dniach lek mu niespecjalnie pomógł. Nic dziwnego: antybiotyk infekcji wirusowej nie wyleczy.
Antybiotyk na wszystko
Antybiotyki przepisywane są zgodnie z objawami, jakie ma dany pacjent. Lekarze je znają i najczęściej dobrze dopasowują lek do typu infekcji. Niekiedy jednak się mylą i wówczas trzeba zażyć antybiotyk z innej grupy, co jest zwłaszcza problemem przy szybko postępujących zakażeniach.
Lekarze niekiedy też przepisują antybiotyki “na wszelki wypadek”, innym razem pod wpływem nacisku ze strony pacjentów. A ci ostatni często nie przyjmują wszystkich przepisanych dawek, przerywając kurację, kiedy tylko pojawia się poprawa. Niekiedy przechowują po kilka tabletek antybiotyku, które zażywają wtedy, kiedy sami uznają za stosowne. W ten sposób w ich organizmach przeżywają bakterie najlepiej uodpornione na daną substancję, a ginie wiele spośród tych, dzięki którym prawidłowo działa organizm, czyli np. składniki flory jelitowej.
Oporność w paczkach
Ale i zażycie pełnej dawki antybiotyku nie daje już pewności wyleczenia, bo presja selekcyjna sprawiła, że bakterie zaczęły tworzyć systemy pozwalające omijać zabójcze działanie antybiotyków. W efekcie wchodzimy w erę postantybiotykową lub, jak mówią inni, wracamy do ery preantybiotykowej.
Bakterie mogą nabyć oporność na antybiotyki dzięki spontanicznym mutacjom, ale też w dużo sprytniejszy sposób, którego jeszcze do niedawna nie podejrzewano. Otóż bakterie – należące nie tylko do różnych szczepów, ale nawet do różnych gatunków (!) – mogą przekazywać sobie wzajemnie geny oporności na antybiotyki poprzez poziomy transfer genów. Odbywa się to za pośrednictwem plazmidów, “ruchomych” cząsteczek pozachromosomowego DNA, które kodują geny oporności i jak paczki przekazywane są innym bakteriom. Takie wymiany genów najłatwiej zachodzą tam, gdzie styka się wiele różnych bakterii, np. w oczyszczalniach ścieków.
Superbakterie, czyli New Delhi u mych drzwi
Problem antybiotykooporności w ogromnym stopniu dotyczy szpitali, gdzie obecność wielu gatunków i szczepów bakterii oraz masowe stosowanie antybiotyków wytworzyło szczególne warunki dla powstawania lekoopornych szczepów bakterii. Przykładem może być MRSA, czyli gronkowiec złocisty oporny na metycylinę, czyli niewrażliwy na wszystkie antybiotyki z grupy beta-laktamów, w tym penicyliny, cefalosporyny, monobaktamy czy karbapenemy.
Swoje trzy grosze dokłada przemysł spożywczy, który do produkcji żywności zużywa ogromne ilości antybiotyków, a te trafiają do naszych organizmów wraz z pożywieniem.
Wskutek tych wszystkich procesów powstały już szczepy bakteryjne odporne na wszystkie klasy antybiotyków, jak np. superbakteria New Delhi, czyli Klebsiella pneumoniae NDM, pałeczka zapalenia płuc, która należy do grupy bakterii jelitowych. Egzotyczna nazwa sugeruje, że zasięg tej bakterii ogranicza się do krajów tropikalnych. A gdzie tam! New Delhi jest obecna w Polsce od 2011 roku i tylko w ubiegłym roku wywołała około 2000 zachorowań.
Takich wielolekoopornych bakterii nie można zwalczyć przy użyciu powszechnie stosowanych antybiotyków, co sprawia, że coraz więcej ludzi umiera na zakażenia bakteryjne – w Unii Europejskiej około 25 tys. osób rocznie.
Gdzie są nowe antybiotyki?
I z tym jest największy problem. Od czasu, kiedy Alexander Fleming w 1928 roku odkrył penicylinę, naukowcy odnaleźli i zsyntetyzowali jeszcze ponad 100 innych związków zwalczających bakterie. Większości tych odkryć dokonano w latach 40.-60. XX wieku. Od 1987 roku na niemal 30 lat zapanował zastój w tej dziedzinie. Dopiero w 2015 roku machina ruszyła na nowo za sprawą naukowców z Northeastern University w Bostonie w Massachusetts, którzy odkryli tejksobaktynę, substancję zwalczającą m.in. gruźlicę, posocznicę i zakażenia wywołane przez gronkowca złocistego. W 2017 roku badaczom z Scripps Research Institute w San Diego w Kalifornii udało się zsyntetyzować dużo skuteczniejszy analog wankomycyny używanej m.in. w walce z MRSA. Sukcesów w poszukiwaniu antybiotyków wciąż jest zbyt mało. Dlaczego?
Antybiotyki, których dziś używamy, są w większości naturalnymi produktami organizmów zamieszkujących glebę – bakterii glebowych i grzybów – służącymi im do walki z innymi drobnoustrojami. Do końca lat 80. naukowcy pracujący nad odkryciem nowych antybiotyków stanęli przed murem, bo okazało się, że przebadali już możliwości wszystkich bakterii glebowych, które chciały rosnąć w laboratorium. Stanowią one jednak niewielki ułamek żyjących w glebie mikroorganizmów, które warunków laboratoryjnych nie tolerują.
Dlatego teraz badaczom pozostaje trudna sztuka zsyntetyzowania nowych antybiotyków, albo też próby badania kolejnych substancji w glebie, poza laboratorium, co również napotyka rozmaite trudności. Stąd zastój w badaniach.
Co to będzie?
Na koniec przytoczę katastroficzne prognozy, o których wspomniałam na początku tego tekstu. Otóż, jeśli bakterie będą się nadal uodparniać na leki, jakimi dysponujemy, a w dziedzinie opracowywania nowych antybiotyków nadal będzie panował zastój, to w ciągu najbliższych kilkudziesięciu lat z powodu zakażeń bakteryjnych znów zaczną umierać miliony ludzi rocznie. Według opublikowanego w 2014 roku raportu przygotowanego przez ekspertów z Review on Antimicrobial Resistance, komisji utworzonej przez brytyjski rząd, do 2050 roku wskutek wzrostu oporności na antybiotyki na świecie może umierać każdego roku nawet 10 mln ludzi. To więcej niż na nowotwory. Czy to realne przewidywania?
Głośny raport Review on Antimicrobial Resistance spotkał się z krytyką szwajcarskich i australijskich naukowców zarzucających Brytyjczykom wymienienie liczby “10 milionów” bez wsparcia jej silnymi przesłankami, odniesieniami do faktów czy realnych scenariuszy. Badacze ci nie podali jednak własnych szacunków co do liczby zgonów w przyszłości z powodu oporności bakterii na antybiotyki.
Tym niemniej wszyscy są zgodni co do tego, że zagrożenie opornymi na antybiotyki szczepami bakterii jest ogromne, stale rośnie i będzie stanowić coraz bardziej palący problem współczesnego świata, a więc coraz więcej ludzi będzie umierać z powodu nieskuteczności leków w walce z zakażeniami bakteryjnymi.
Co my możemy zrobić?
Nadzieją w walce z antybiotykoopornością u bakterii jest wykorzystanie bakteriofagów (czyli wirusów zwalczających bakterie). W badaniach nad tym jednym z bardziej zaawansowanych ośrodków jest Instytut Immunologii i Terapiii Doświadczalnej PAN we Wrocławiu.
Niedawno usłyszeliśmy też o nowej metodzie wykrywania genów oporności na antybiotyki u bakterii, tworzonej przez doktorantów z Zakładu Genetyki Bakterii na Wydziale Biologii Uniwersytetu Warszawskiego. Pomysł ten opiera się na wykorzystaniu metody prostej i powszechnie stosowanej w szpitalach i laboratoriach – chodzi o PCR (Polymeraze Chain Reaction – reakcję łańcuchową polimerazy), która powiela materiał genetyczny do badań. Doktoranci opracowali oprogramowanie, dzięki któremu można błyskawicznie dobrać takie odczynniki, które bezbłędnie wskażą w powielanym materiale genetycznym bakterii fragmenty odpowiedzialne za lekooporność. Jak zapewniają wynalazcy, to może nawet 10-krotnie przyspieszyć analizę w porównaniu do klasycznego antybiogramu. Od wdrożenia tej metody dzieli nas jeszcze kilka lat.
A czy my sami już teraz możemy coś zrobić, by ograniczyć szerzenie się lekooporności u bakterii? Światowa Organizacja wskazuje trzy takie punkty:
– Używać wyłącznie antybiotyków przepisanych przez lekarza (i nie naciskać, by przepisał antybiotyk na infekcję wirusową*);
– Zażywać wszystkie przepisane dawki antybiotyku, nawet jeśli już czujemy się lepiej;
– Nigdy nie odstępować swoich antybiotyków komuś innemu i nie zażywać dawek niewykorzystanych wcześniej.
*uwaga ode mnie


You must be logged in to post a comment.